3.L’INGENERIE ENZYMATIQUE & SES PROPOSITIONS BOULANGERES
3.1. LES DIVERS AMYLASES SUR LE MARCHE
On reprend ce granule d'amidon schématisé afin de comprendre ce qu'est l'ingénierie enzymatique qui se retrouve dans notre sac de farine.
Ce granule est composé de deux types d'amidon.

Il est nécessaire de comprendre ces différences puisque dans l'amylose, les molécules de glucoses sont liées par l'atome carbone 1 de la molécule qui précède, à l'atone carbone 4 de la molécule de glucose qui suit.
Dans le cas de l'amylopectine, (un amidon qui contient un pouvoir plus gélifiant que l'amylose, d'où son nom), là où il existe un branchement, la molécule de glucose se situant au départ de la ramification est liée toujours à partir du carbone 1, mais au carbone 6 de la molécule qui fait le branchement.
En schématisé, cela donne ceci.

Revenons sur notre schéma de granule d'amidon.
Il est ici dégradé par une amylase, mais il n'existe pas une seule sorte d'amylase.
Nous avons vu (chap.2.3.5.), que dans les amylases natives du blé, il y a deux sortes ; l'alpha-amylase et la bêta-amylase.
La bêta-amylase ne sait couper les chaînes de molécules de glucose qu'à partir du bout et en scindant par groupe de deux molécules de glucose ( = maltose) à la fois.
Mais elle arrêtera son action de dégradation à l'approche des départs de ramifications, là ce n'est plus son domaine.

L'alpha-amylase du blé peut dégrader la chaîne de molécules de glucose en coupant m'importe où.
Sauf qu'elle aussi ne sait pas dégrader (couper) les endroits où il y a des branchements, de nouveau ce n'est pas de son ressort.

Avec les amylases natives du blé, le noyau du granule d'amidon reste presque intact avec ce qu'on appelle des «dextrines limites». Ici, l'expression de la démarcation des possibilités des enzymes natives.

L'α-amylase fongique venue sur le marché dans les années 1950 en Allemagne et plus de quinze après en France, a l'avantage d'avoir une température d'optimum d'activité ainsi qu'une température d'inactivation, 10 °C en dessous de l'α-amylase native du blé [1]. Ce qui lui donne un petit risque en moins, au niveau surdosage, vu son inactivité plus rapide.
En voulant aller plus vite dans la dégradation enzymatique, on s'est dit qu'on va ajouter une enzyme amylase qui sait débrancher et couper ces liaisons carbone 1/carbone 6.
C'est la pullulanase qui doit son nom à la dégradation des pullulanes.
Le pullulane est le nom donné à un sucre composé de trois molécules de glucose (= maltotriose), lié entre eux par l'atome carbone 1 et l'atome carbone 4. Au bout du maltotriose pour réaliser d'autres liaisons, il n'existe que la possibilité d'une liaison entre les atomes carbone 1 et 6.

Et on a trouvé une pullulanase produite par un bacille [2] qui débranche les ramifications, ce qui donne un granule d'amidon dégradé comme ceci ;

Mais on peut aussi aller prendre l'enzyme amyloglucosidase produite par une moisissure [3] qui elle est capable de couper toutes les types de liaisons (1,4 comme 1,6), ce qui donne ce résultat.

Le manque de rapidité de l'action (l' «amélioration» de la panification n'a prioritairement que cet objectif) de cette enzyme fait qu'elle ne répond toujours aux attentes des formulateurs [4] qui préfèrent rencontrer la demande plus rentable de la vitesse d'exécution.
Maintenant que l'on voit qu'une amylase n'est pas l'autre et que finalement l'ingénierie enzymatique peut nous préparer n'importe quel type de frappe quasi chirurgicale, il faut encore différencier ces alpha-amylase, pullulanase et glucoamylase entre-elles.
Suivant qu'elles proviennent de microorganismes différents, elles peuvent avoir des dispositions différentes et suivant ce que va vivre le milieu pâteux, ce sera vrai surtout pour les alpha-amylases.
Les températures et le niveau d'acidité déterminent des zones d'activité différentes, et là aussi il existe des choix et le cocktail enzymatique risque d'être différent.
3.2.L'AMYLASE BACTERIENNE ET LE MOELLEUX
3.2.1.L'expérience de BOUSSINGAULT

C'était en 1852, que Jean-Baptiste BOUSSINGAULT (1802 - 1887), lance des «expériences ayant pour but de déterminer la cause de la transformation du pain tendre en pain rassis».
Car pour lui, «ce changement d'état suit l'abaissement de la température, et il ne m'a jamais paru qu'il fût raisonnable de l'attribuer à un effet de dessiccation».
Son expérience consiste à évaluer la perte en eau du pain pendant le rassissement.
Après six jours, la perte de poids du pain n'était que de 40 gr. par rapport à un poids de départ de 3.730 gr., soit une perte d'un tout peu petit plus de 1%.
Voici le tableau de l'expérience de 1852 qui sera encore repris par Emile Boutroux en 1897.

Au bout des quatre pages relatant ses expériences dans les annales de chimie et de physique[5], sa conclusion est «que ce n'est pas par la moindre proportion d'eau que le pain rassis diffère du pain tendre, mais par un état moléculaire particulier qui se manifeste pendant le refroidissement, se développe ensuite et persiste aussi longtemps que la température ne dépasse pas une certaine limite».
3.2.2. La rétrogradation de l'amidon
Cette expérience probablement que tout boulanger l'a vécu en «repassant» des pains au four.
Alors c'est quoi cet «état moléculaire particulier» dont Jean-Baptiste BOUSSINGAULT fait référence.
On l'appelle aujourd'hui la rétrogradation de l'amidon !
Etes-vous plus avancé avec cette définition?
Une petite image pour la compréhension…

En fait, c'est comme si l'amidon se recristallisait.
Une autre image plus parlante, peut'être.

C'est bien tout ça, mais on écrit au début, «comprendre l'ingénierie enzymatique» ?
3.2.3. La thermo-résistance amylasique
C'est que l'astuce est de repérer dans toutes les amylases qui existent, celles qui résistent à la cuisson [6].
L'idée est d'en maîtriser la fonction de dégradation après la cuisson. On l'a doit en terme de proposition commerciale à la firme d'origine danoise Novozymes en 1991 [7], Avant cela dans la littérature technologique française, l'amylase bactérienne était évitée pour ces raisons de thermo-résistance.[8]
On connaissait déjà en boulangerie des problèmes de résistance à la cuisson par la maladie du pain filant dit «ropy» en anglais, c'est-à-dire visqueux vu l'état du pain qui malgré qu'il soit cuit redevenait flasque.
C'est le bacille dits populairement «des foins» (apparaissant à l'époque caniculaire de la fenaison) qui est responsable de cette maladie du pain filant, il est dit thermorésistant, ce que J.-B. BOUSSINGAULT avait déjà pu mettre en évidence, puisque dans son expérience en mettant le thermomètre dès la sortie du four à 7 centimètre de la surface (croûte) du pain, celui-ci indiquait 97°C, moins que les 100°C fatidique pensait-on à l'époque.
On appelle aujourd'hui le bacille «des foins», bacille subtilis (autrefois bacille mensentericus) et son enzyme amylase est encore fort active à 70 à 80°C.
Mais un autre bacille est encore plus performant, c'est le bacille appelé licheniformis puisqu'il aurait, (vu au microscope), la forme un peu «fleurie» de lichens. Là c'est à 90 à 95°C que se trouve la température optimale de leur amylase.
Elle sait encore mieux résister à la cuisson à l'intérieur du pain.
3.2.4. Le débranchage après cuisson
Et une fois le pain cuit, ces amylases peuvent être toujours active sur l'amidon en diminuant l'enchevêtrement du réseau recristallisé (dense) de l'amidon (à gauche sur le schéma ci-dessous) en coupant des branchements (au centre) ou en sectionnant à partir des extrémités des ramifications d'amidon, deux molécules de glucose (maltose) par deux molécules de glucose, (à droite) action dite maltogénique pour l'amylase du bacille stearothermophilus.
Ces actions seront limitées aux zones cristallines séparées[9].

D'où la mention de non-interférence sur le volume et la texture employée par l'ingénieure de la firme novatrice quelques notes plus haut dans ce chapitre 3.2.
Elle les réalisent en utilisant aussi les propriétés (agents dépresseurs d'Aw) des dextrines [10]. Ces actions permettront à la mie de pain cuite ainsi traitée de garder plus longtemps son moelleux. L'utilisation de ce type d'enzymes devra se réaliser avec précaution dans un but bien particulier [11] pour ne pas prolonger la formation de dextrines pendant la cuisson.
Deux problèmes cependant ;
1-/ La classification de l'enzyme dans les auxiliaires technologiques ne répond plus à la définition de ceux-ci par la législation européenne.
«On entend par «auxiliaire technologique» toute substance non consommée comme ingrédient alimentaire en soi et volontairement utilisée dans la transformation des matières premières, des denrées alimentaires ou de leurs ingrédients, pour répondre à un certain objectif technologique pendant le traitement ou la transformation et pouvant avoir pour résultat la présence non intentionnelle de résidus techniquement inévitables de cette substance ou de ses dérivés dans le produit fini et à condition que ces résidus ne présentent pas de risque sanitaire et n'aient pas d'effets technologiques sur le produit fini.» [12].
2-/ Le risque sanitaire d'allergie ou d'intolérance risque de prendre un certain temps avant de pouvoir être décelé et pour cela il faudrait afin d'évaluer le risque que le produit de cuisson en contenant fasse mention de sa présence, ce qui n'est malheureusement pas le cas.
3.3. Les hémicellulases, pentosanases où xylanases
3.3.1.Une nouveauté, ces hémicellulases?
Voilà ces mots «pentosanases» ou «hémicellulases» dont on n'avait jamais beaucoup parlés, il y a vingt ans d'ici. Aujourd'hui, c'est à peine si les cours théoriques de boulangerie en parlent. Et pourtant, actuellement on les retrouve sur les étiquettes de nos sacs de farine.

On a vu au chapitre 2.5., que ces enzymes sont natives dans la farine, mais que c'est depuis leur introduction dans les complexes enzymatiques où améliorants que le secteur y prête attention.
3.3.2. Les diverses noms des hémicellulases
Une des difficultés pour la compréhension, sont les différents noms employés en dénomination. Déjà pour le substrat dégradés (les sucres pentoses), il existe une confusion [13].

De nombreuses variétés d'hémicellulases existent sur le marché.
Il faut attribuer cette diversité à la plus grande complexité des ces chaînes de sucres pentoses par rapport aux chaînes d'hexoses (glucose) qu'est l'amidon [14].

Plusieurs firmes productrices d'enzymes ont d'ailleurs une gamme importante d'hémicellulases [15] ce qui démontre cette multiplicité d'actions potentiels. L'action des xylanases (la troisième dénomination) se différencie, comme les amylases, avec l'impossibilité ou pas de dégrader aux approches de branchements ou ramifications[16]. Il existe, comme pour les protéases, non seulement la potentialité des dégradations en de toujours plus petites portions, mais aussi des possibilités de connexion en de plus longues assemblages, intra-éléménts (entre chaînes pentosanes) et parfois inter-éléments (entre chaînes pentosanes et chaînes de protéines).
3.3.3. Les diverses pentosanases
Pour profiter technologiquement des hémicellulases, il importe, comme toujours, de ne pas trop dégrader les chaînes de celles-ci. L'on a remarqué par exemple que les coupes des endo-xylanases (séparation opérée à l'intérieur de la chaîne de xylose[17]) se réalisaient plus difficilement à l'endroit où les sucres pentoses arabinose se trouvaient en lien [18] ou jonction sur le chapelet de xylose. Ce qui procure des plus longs bouts de chaînes de xylose, comme pour les dextrines limites (voir chap.0.16), intéressants technologiquement [19] par leur plus faculté de capter l'eau ou de réaliser une meilleure viscosité.

Par contre, à l'inverse, si l'on veut rendre cette chaîne de pentosanes plus facilement dégradable en petites portions, une action spécifique séparant la molécule d'arabinose de la chaîne de xylose rendra celle-ci plus apte à réaliser cette action [20].

Autre particularité d'action sur les pentosanes, comme il existe des pentosanes insolubles, il est préférable de de rendre celles-ci solubles [21] plutôt que dégrader les pentosanes solubles.
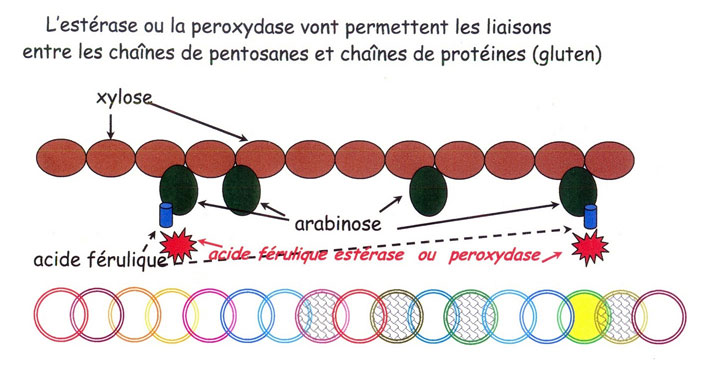
Dernière action, les pontages entre chaînes de pentosanes où entre chaînes de protéines et chaînes de pentosanes se réalisent grâce à des enzymes estérases sur les acides férulique où coumarique [22] attachées à la molécule d'arabinose elle-même attenante à la chaîne de molécules de xylose.

Cette action ne se réalise alors que grâce à l'oxydation de ces acides. Ce qui sera en quelque sorte «forcé» par l'ajout d'enzyme oxydase permettant d'effectuer plus rapidement ce travail de ponts hydrogènes dits aussi phénoliques (voir chap.2.4.6.).
3.3.4. Les liaisons entre pentosanes
Une fois l'acide férulique estérifié, il va pouvoir se lier à une autre acide férulique (l'acide se dénommera acide diférulique).
Ce qui donnera lieu à ce pontage entre deux chaînes de pentosanes.

Le tout permet de réaliser, à cru, un effet mousse gélifié que l'on peut schématiser comme suit pour une compréhension simplifiée ou l'on voit apparaître en éclats les acides féruliques prêt à se réunir par l'oxydation.

Ces acides devenus ; diférulique par leurs jonctions, créent comme un gel pâteux.

3.3.5. Les liaisons entre les chaînes de pentosanes et chaînes de protéines
Autre liaison qui peut se réaliser entre chaîne de protéines et chaînes de pentosanes. Cette une liaison dite hydrogène ou phénoliques entre un atome d'hydrogène et un atone d'oxygène vu au chapitre 2.4.6..
Deux acides aminés semble les plus sollicités dans ces liaisons [23], il s'agit de la tyrosine et de la cystéine. La deuxième étant déjà sollicitée pour les ponts disulfurés.
Cela se passe entre l'acide férulique de la chaîne des pentosanes et les acides aminés de la chaîne de protéines.
Les voilà expliqué en schématisant sur une succession de deux figures.


3.4. Les oxydases en panification.
3.4.1. L'effet de Serres au XVIème siècle
En 1600, Olivier de Serres parle de qualité du grain et de la farine, il fait, comme beaucoup à cette époque, une différence entre farine issue du blé battu de l'épi, soit depuis longtemps ou depuis peu. Il préfère les second, à servir pour les maîtres, tandis que les premiers seront servi aux servant(e)s.

Il évite une oxydation en quelque sorte, en préférant une farine issue de grain qui n'a pas trop de «plancher». Mais bien sur, cette citation tient plus de l'observation à une époque où la science commence à peine à se structurer. Il écrit aussi plus loin, qu'«une farine se conservera longtemps (plus de 7 à 8 mois) si on la moud dans le décroissant de la lune» [24]. Comme il répètera [25] une croyance populaire sans la contrôler; «le blé mal cultivé se transforme en ivraie».
3.4.2. Le vécu «oxydases» dans la pâte
Plus actuel et pour ressentir ce thème des oxydases au fournil, il suffit d'observer la différence entre une pâte morte (dite aussi verte) et une pâte à maturité. Cette dernière a plus de corps, plus d'aération, de vie en somme. Ce qui donne à une pâte «un âge mûr» c'est une oxydation qui peut parfois se dénommer ; maturation ou «prise de force».

C'est principalement au pointage que s'opère ce passage «de la jeunesse à l'âge adulte». Le pointage, cette fermentation de la pâte en masse est de plus en plus négligée dans nos fournils. C'est pourquoi dans une volonté de solution afin de panifier «vite et bien», le professeur Calvel avait préconisé [26] un ajout de pâte pré-fermentée [27] apportant plus rapidement cette maturité à la pâte qui en bénéficie. Dans les processus industriels, le pointage à être carrément abandonné lorsqu'il s'agit de faire vivre à la pâte, la congélation.
3.4.3. Vite ! Speed ! Fast ! Une obession aiguisée en boulangerie aussi
De tout temps, on a voulu aller plus vite et sous toutes les latitudes de la vie, l'obtention de la maturité a toujours été un empressement difficile à gérer.
En plus, au niveau commercial, soumettre la maturité de la pâte à l'exercice de rentabilité économique va inévitablement faire l'objet de recherche de «raccourcis». Pour l'oxydation en meunerie-boulangerie, cela ira des gaz oxydants la pâte à l'ajout d'additifs oxydo-réducteurs en passant autrefois par des traitements à l'arc électrique [28].
De toutes ses formes d'acquisition rapide de la maturité de la pâte, ne retenons ici que le prédécesseur autorisé et le plus utilisé en France, les quelques dizaines de milligrammes d'acide ascorbique ajouté au kilo de farine. Nous avons déjà vu au chapitre 1.10., que c'est le décret dit «de tradition française» en 1993 qui exclura l'acide ascorbique. Cela va, en quelque sorte, promouvoir l'enzyme glucose-oxydase et le passage de l'additif à l'auxiliaire technologique dans ce domaine de l'oxydation. La teneur native d'acide ascorbique ou vitamine C, est minime dans la farine. Par conséquence, les teneurs natives des enzymes acide ascorbique oxydase et acide ascorbique déshydrogènase existent aussi. Si ce détail est important, c'est simplement pour signaler que ce soit additif ou auxiliaire technologique, les réactions d'oxydo-réduction enclenchées sont enzymatique quelque soit l'origine de la «catégorie légale» de l'agent engendrant l'oxydation.
Dans l'objectif fixé, de permettre un discernement professionnel du boulanger, il sera utile de mesurer le potentiel d'oxydo-réduction d'une pâte et d'évaluer les diverses interventions proposées aujourd'hui par l'ingénierie enzymatique.
3.4.4. La mesure du potentiel d'oxydation d'une pâte
Il existe en France, un laboratoire du Conservatoire des Arts et Métiers (CNAM) ou une équipe s'attelle à cette tâche de la mesure du potentiel d'oxydation de la pâte. Depuis pas mal d'années, on fait des recherches au point d'avoir créer de toutes pièces deux instruments de mesure spécifiques. En 1993, est construit le pétrin bio-réacteur, en 2003 ce sera le sitoxygraphe qui sera élaborer avec les connaissances accumulées au cours des dix années précédentes.
Une brève présentation des deux outils s'impose si l'on veut comparer les mises en situation opérée scientifiquement avec les méthodes qui seront rencontrées au fournil.
Le pétrin bioréacteur du CNAM (1993)

Dans une cuve où les paramètres (T°) sont contrôlés, le petit fraseur va opérer 1.200 rotations dans une pâte hydratée à 70%.
L'instrument permet d'analyser les gaz
Le sitoxygraphe du CNAM (2003)

C'est un axe à l'horizontal qui pétri la pâte hydratée à 60% avec +/- 1.200 rotations
Un sas permet les retraits sans interférences.
L'analyse porte sur les gaz également.
Réalisé grâce au soutien des groupes Soufflet et Puratos
Deux caractéristiques se rencontrent plus en procédé de pétrissage industriel qu'artisanal. Les 1.200 rotations (encore que l'on peut relativiser), et les pétrins fermés. Dans l'évolution de la boulangerie artisanale, un désengagement vis-à-vis du travail intensif au pétrissage pour se réinvestir vers des temps de fermentation plus long a été la tendance ces derniers temps.

3.4.5. Oxyder au pétrissage ou en fermentation ?
En 1767, dans un des premiers manuels de boulangerie française, on trouve ces expressions ; «Pour bien composer la pâte et pour faire du bon pain, il faut que la pâte soit suffisamment travaillée et par les levains et par les bras». D'ailleurs «lorsque l'on emploie moins de levain, il faut plus de travail et on est obligé d'y employer plus de levain lorsqu'on la (la pâte) travaille moins», relate Paul Jacques Malouin [29] et à la page suivante celui-ci signale encore qu' «à Paris, on fait dépendre la bonté du pain, plus des levains que du travail». Plus loin dans l'écrit «Le travail du levain dans la pâte surpasse encore celui des mains».
Depuis, tout comme au Conservatoire des Arts et Métiers créé un peu plus tard (1794), beaucoup d'eau à couler sous les ponts de la Seine.
Les conditions sociales ont changé, le pétrissage n'est plus manuel et le levain après être tombé en désuétude ne reprend de la pratique que depuis deux à trois décennies. Comme le montre le tableau suivant, les changements opérés en panification iront renforcer le pétrissage et diminué les temps de fermentation. On monte de 300 tours à 1.200 tours au pétrissage et on descend de 6 h.30' jusqu'à 1 h. en fermentation.
Il n'en est pas moins vrai que le pétrissage et la fermentation sont deux opérations qui oxydent la pâte, plus on insiste sur une des deux, moins il faut mettre d'accent sur l'autre.

Dans la balance, c'est le pétrissage qui a pris du poids par rapport au positionnement décrit dans les premiers manuels.
Un point qui s'observe aussi plus dans l'artisanat que dans l'industrie, c'est quand il faut choisir, on préfère marier les deux éléments (farine / eau) plus par capillarité en longue fermentation qu'en les fouettant longtemps ensemble.

Comme l'espace fermentation est l'endroit ou se forme le goût, ainsi que beaucoup de meilleures bio-assimilation et épuration dans le cas de la panification au levain [30], favoriser l'option de la fermentation sur le pétrissage semble bien, «couler de source».
3.4.6. L'oxygène ; un ingrédient des pâtes !
L'équipe du CNAM sort en 2010 un article reprenant le parcours de 17 années d'expériences conduites avec les deux pétrins instrumentés. D'emblée on y précise que du fait de l'incorporation d'un oxydant (l'oxygène de l'air) ; «Pétrir c'est oxyder». Le titre de l'article «L'oxygène, un ingrédient oublié de la pâte» [31] détermine bien ce que les études veulent cerner. Que se passe-t-il avec l'oxygène dans la pâte ?
Qu'oxyde-t-il ? Une recherche [32] va jusqu'à donner 60% de la consommation d'oxygène par les acides gras, pourtant peu nombreux dans la pâte de blé tendre, mais tellement aisément hydrolysables (par les lipases) puis oxydables (voir chapitre 2.2.). Le glucose oxydé par la levure (qui respire et fermente) prend 10% de la consommation d'oxygène [33]. Nous arrivons à un total de 70%. Les 30% d'oxygène consommés restant ne sont pas encore expliqué, bien que quelques pistes soient à confirmer [34]. Si l'on ajoute des agents oxydants du type ; farine de fève et son enzyme lipoxygénase ou l'enzyme exogène, glucose-oxydase, on augmente la consommation d'oxygène.
On remarque que la principale voie de la consommation d'oxygène est l'oxydation des acides gras par l'enzyme lipoxygénase endogène (ou native).
3.4.7. La lipoxygénase, une des premières enzyme oxydase décrite.
Lorsque Roger DRAPRON décrit l'action de la lipoxygènase dans la pâte, en 1974 [35],

il en dépeint plutôt les aspects négatifs. Ce n'est pas tellement l'enzyme lipoxygénase native qu'il met en cause [36]. Mais plutôt celle que l'ajout de la farine de fève apporte en excès (100 fois plus efficiente). Celle-ci couplée à «l'augmentation de l'intensité du pétrissage, généralisée depuis une vingtaine d'année modifie considérablement l'importance de l'effet de la lipoxygènase». [37] Le professeur Raymond CALVEL emboitera le pas et dans la campagne contre l'ajout de farine de fèves, il qualifiera l'action dévastatrice de «lessivage». [38] Terme bien repris dans les fournils.
Suite à ces dénonciations et rimant trop avec vent, l'adjuvant farine de fèves va progressivement disparaître.

Autre récente évolution, mais plutôt chez les anglo-saxons, l' «unbleachead» = farine «non blanchie» par des gaz oxydants, sera vue comme positif.
A suivre les explications techniques et scientifiques des enzymes « oxydantes »
[1] Voir les renseignements cités au chapitre 1.8.
[2] Il s'agit du bacille acidopulluliticus, la pullulanase fut autorisée en France en 1993 et on lui attribue parfois les mêmes qualités de préservation du moelleux grâce à ce «débranchage» de l'amylopectine, encore faut-il que l'enzyme soit thermorésistante, par conséquent classée comme additive et plus comme auxiliaire technologique.
[3] Il s'agit de l'Aspergillus niger, l'amyloglucosidase fut autorisé en France en 2001
[4] Le «formulateur» n'est pas forcément un fabricant d'enzymes. Il peut acheter ceux-ci chez le fabricant et composé les coktails en fonction de l'état de la récolte ou des demandes spécifiques des clients.
[5] Pour les personnes intéressées par l'enquête de 1852 de J.-B. Boussingault, «Approche ayant pour but de déterminer la cause de la transformation du pain frais en pain rassis», on sait la télécharger en ligne sur le site http://gallica.bnf.fr
La démarche est la suivante; choisir l'onglet > Presse et revues >> Tapez dans la recherche; Annales de chimie et physique, cliquez sur Accéder à tous les volumes, Choisir l'année 1852, Dans cette année choisir dans la série 3, le tome 36, et puis aller aux pages 490-494 que vous pouvez télécharger en cochant correctement les pages que vous souhaitez.
[6] J.-P.LARPENT & M.LARPENT-GOURGAUD, p. 261, signalent que «la thermostabilté des enzymes est d'abord due à la séquence des acides aminés et à un certain nombre de facteurs de stabilisation (hydrophobicité, liaison métallique, création de paires d'ions avec le substrat glycosylation) . L'α-amylase de Bacillus stearothermophilus a une température optimale d'action à 65°C., celle de Bacillus licheniformis de 90°C.»
[7] Voir le site de Novozymes qui relate l'année 1991 pour le lancement de Novamyl et L'impact des enzymes article de Cécile CHEVREUX, paru dans la revue Filière Gourmande N° 86 de mars 2002 qui donne les commentaires de Christine ROSA ingénieur chez Novozymes France ; «En effet, sans risque de surdosage et sans interférer ni sur la consistance des pâtes, ni sur la structure de la mie ou le volume des produits, Novamyl opère directement sur le moelleux des produits de boulangerie dès J + 1 en retardant la rétrogradation de l'amidon tout au long de la conservation»
[8] J.POTUS et coll. (1996) écrivent p.10 pour les risques de correction amylasiques à inactivation élevée «plus encore pour l'α-amylase bactérienne, l'activité de celle-ci étant prolongée pendant la cuisson, la quantité de dextrines formées peut être importante et le volume du pain réduit». Deux freins se présentaient à l'emploi d'amylases bactériennes. Le fait que l'on ne voyait comment maîtrisé une dégradation après cuisson et la réalité législative du statut d'auxiliaire technologique qui empêche la présence intentionnelle du produit dans le produit consommé.
[9] B.GODON, (1994), p.425
.
[10] J.POTUS, R.DRAPRON et A.POIFFAIT, (1994), p.441
[11] POTUS et R.DRAPRON, (1997), p.126
[12] Directive 89/107/CEE, art. 1er point 3
[13] Bernard GODON, 1998 écrit, p. 58, « En général, le terme hémicellulose correspond à la partie insoluble dans l'eau, pentosane à la fraction soluble ». Malgré cela on retrouvera le terme «pentosane» employé indifféremment pour les solubles et les insolubles d'autant que les deuxième deviennent solubles au cours des transformations enzymatiques lors de la fermentation.
[14] Lutz POPPER de Mühlenchemie écrit p.1, «Le terme d'hémicellulase désigne une famille d'enzymes dont les membres, sont capables de décomposer les pentosanes. Leur impact sur la panification et les propriétés de la pâte varie toutefois beaucoup d'une enzyme à l'autre»
[15] Les fabricants d'enzymes allemands (Röhm et Mühlenchemie) ont su préserver leurs initiatives en matière de production d'hémicellulases. La première (aujourd'hui devenue AB Enzymes) qui a été précurseur de ce domaine des pentosanases présente une quinzaine de xylanases en mélange ou pas avec des amylases fongiques et des xylanase transglutaminase, c'est-à-dire une xylanase qui permettent de se lier avec les protéines. Des xylanases bactériennes qui ciblent parfois les hémicelluloses insolubles avec un bulletin final couché sur prospectus commercial ; d'extensibilité, régulation et volume. La deuxième firme allemande, (Mühlenchemie) présente une douzaine de propositions avec également des mélanges amylases et hémicellulases et cible pratiquement les mêmes effets. Des spécificités pour la panification du seigle ou pour de longues fermentations sont également rencontrées. Voir ; les sites de ces deux firmes, notation de juillet 2011; http://www.abenzymes.com et http://www.muehlenchemie.de
[16] Voir J.-P. LARPENT et M. LARPENT-GOURGAUD, p.328. écrivent déjà en 1990, qu'il existe 6 types de xylanases. Certaines sont capables de détruire les liaisons au point de ramification, d'autres pas. Lorsqu'elles coupent les branchements, elles peuvent différer par les produits terminaux formés ; xylose (1 molécule), xylobiose (2 molécules attachées), xylooligosaccharides (plusieurs molécules de xylose liées entre-elles). Lorsqu'elles sont incapables de supprimer les points de ramification, elles donnent des oligo-saccharides plus grands que le xylobiose. Enfin certaines xylanases ne savent pas couper les liaisons avec l'arabinose et de ce fait ne produisent que du xylose (une molécule) et du xylobiose (plusieurs molécules de xylose accolées l'une à l'autre).
[17] La liaison entre deux molécules de xylose s'effectue entre l'atome de carbone 1 et l'atome de carbone 4
[18] La liaison de la molécule d'arabinose sur la molécule de xylose s'effectue soit le carbone 2 ou le carbone 3 du xylose.
[19] C'est pour cette raison que ce sont les endo-xylanases qui entreront de manière préférentielles dans le choix d'hémicellulases en panification, puisqu'elles permettent de garder de plus grandes chaînes d'arabinoxylanes contrairement à une dégradation opérée par des exo-xylanases qui coupent à partir des extrémités deux molécules de xylose par deux molécules de xylose, à l'image des bêta-amylase.
[20] Cette action est réalisée par l'enzyme arabinofuranosidase.
[21] H. PETRICH-MURRAY et P.DUCROO, écrivent, p.13 ; «Il ne semble pas qu'une différence importante de composition existe entre les formes soluble et insoluble. Le poids moléculaire et le degré de ramification interne de la molécule expliqueraient la différence de solubilité».
[22] Ces deux acides sont parfois regroupés sous le nom d'acide cinnamiques avec l'acide sinapique, ils se retrouvent principalement dans la fraction insoluble des pentosanes (à 88% pour la farine, à 81% pour la pâte). L'acide férulique est majoritaire (entre 84 à 86%), l'acide coumarique est minoritaire (2%) et diminue au cours du pétrissage. L'acide sinapique est à 4% des acides cinnamiques et sa teneur augmente à 9 % dans les pâtes. Voir ; L.RAKOTOZAFY et coll., p. 19.
[23] Jacques POTUS et col., Les oxydoréductases en panification, 1999, p 7.
[24] O. de SERRES, p.816 et 817
[25] O. de SERRES, p.104
[26] «Il faut faire avant ce qui est difficile de faire après», écrira le professeur CALVEL (2002, p.8) dans l'éditorial intitulé Vite et bien, de la revue «Le Boulanger-Pâtissier», d'avril 1980.
[27] L'ajout de pâte pré-fermentée doit être précisé.
C'est un apport d'une pâte confectionnée antérieurement et qui dépasse rarement en volume les 20% du total de la pâte. Conservée en température ambiante, elle ne devrait pas trop excéder une heure en durée. Si plus, afin de préserver ces qualités d'apport de maturation et ne pas verser dans l'apport d'assouplissement ou elle risque d'engendre du collant, elle doit se conserver au froid positif (10°C ou moins).
[28] Lire L'amélioration et les améliorants pour en savoir plus à ce sujet.
[29] P.J.MALOUIN, p.237, 238 et 266
[30] Pour plus de précisions ; voir le cours sur le levain à son chapitre II.7.
[31] J. POTUS et coll., mars 2010. p.3, «l'oxygène est intéressant avec … son caractère oxydant, renouvelable et gratuit», p.4 ; «on peut même considérer l'oxygène comme le 5ème ingrédient de la pâte après, la farine, l'eau, la levure et le sel»
[32] A. EYOUM et coll.
[33] Masood DEHKARGHANIAN et coll.
[34] J. POTUS, mars 2010. p.7. On sait notamment que lors de l'ajout de glucides-oxydases nécessaire aux ponts phénoliques créés par les estérases de l'acide férulique augmente la consommation de +/- 4 %. L'ajout de farine de légumineuses riche en lipoxygénase ou d'autres enzymes lipases hydrolysant les acides gras favorisera la consommation d'oxygène.
[35] Voir ; R.DRAPRON, Y.BEAUX, M.CORMIER, J.GEFFROY et J.ADRIAN, 1974.
[36] A.BOUSSARD et coll., mai 2010, p.7 signale que la lipoxygénase native oxyde presque exclusivement les acides gras polyinsaturés libres, les lipoxygénases de fève et de soja oxydent les acides gras polyinsaturés libres et ceux portés par les triglycérides, mais les acides gras polyinsaturés libres restent majoritairement oxydés par ces deux enzymes.
[37] R.DRAPRON et D.RICHARD-MOLARD, 1977, p.149. Signalons pour restituer le contexte des années 1950-1970, qu'à l'époque l'on voulait sortir d'une période de «pain noir», (la guerre 1940-45) et que vers les années 1970, les publicités des produits de lessive avaient inventé une «nouvelle» couleur ; «le plus blanc que blanc».
[38] R.CALVEL, 2002, p.181 dans l'éditorial « Avoir raison … malgré tout » de la revue « Le boulanger –pâtissier » de mai 1981. Page 273, dans un autre éditorial de la même revue en décembre 1986, intitulé ; «Des idées qui font leurs chemins», le professeur Calvel apprenait que dans certains moulins importants les farines sans fève représentaient de 30 à 40% des ventes. Ce qu'il considère comme un acquis positif
Auteur : DEWALQUE Marc, BoulangerieNet.Janvier 2012









